Asthma Diagnose und Therapie Evidenzbasierte Leitlinie zu Diagnose und Therapie.
Entwickelt durch das medizinische Wissensnetzwerk “evidence.de” der Universität Witten/Herdecke Version 01/2004
Eine Aktualisierung dieser Leitlinie ist nicht geplant (Stand September 2007)
Haupttext Die hier vorliegende Version richtet sich an Ärzte und Gesundheitsfachleute.
Für Asthmakranke, Eltern und Betreuer existiert eine Patientenleitlinie. Die Leitlinie “Asthma bronchiale” in der Version 01/2004 nimmt Bezug auf andere nationale und internationale Leitlinien-Dokumente, die übersetzt, inhaltlich und formell überarbeitet und an hausärztliche Erfordernisse angepasst wurden. Eine Aktualisierung wird nicht mehr vorgenommen. Asthma bronchiale Gliederung - 1. Einleitung
- 1.1 Asthma Versorgungsproblem
- 1.2 Adressaten (Zielgruppe) der Leitlinie, Ausschlusskriterien
- 1.3 Ziele dieser Leitlinie
- 1.4 Einteilung der Empfehlungsklassen und Evidenzstärken
- 1.5 Wichtigste Quellen dieser Leitlinie
- 2. Definitionen, Ätiologie, Komplikationen des Asthma bronchiale
- 2.1 Definition und Charakteristik
- 2.2 Epidemiologie
- 2.3 Ätiologie, Asthmaformen
- 2.4 Ursachen, Risikofaktoren, Prävention
- 2.5 Prognose, mögliche Komplikationen (Abwendbar gefährliche Verläufe)
- 2.6 ICD-Klassifikation
- 3. Diagnosestellung des Asthmas
- 3.1 Symptome des Asthmas
- 3.2 Basisdiagnostik
- 3.2.1 Anamnese
- 3.2.1.1 Anamnestische Erhebung möglicher Trigger
- 3.2.2 Körperliche Untersuchung
- 3.2.3 Empfehlungen – Anamnese und körperliche Untersuchung
- 3.3 Laboruntersuchungen
- 3.3.H Weitere Laboruntersuchungen
- 3.3.1 Empfehlungen Laboruntersuchungen
- 3.4 Technische Untersuchungen
- 3.4.1 Spirometrie
- 3.4.2 Peak-flow-Messung (PEF)
- 3.4.2.1 Normwerte der Peak-flow-Messung
- 3.4.2.2 Diagnosekriterien der Peak-flow-Messung
- 3.4.2.3 Empfehlungen - Peak-flow (PEF)-Messung
- 3.4.2.H Limitation des Peak-flow (PEF) -Protokolls
- 3.4.3 Diagnosekriterien der Atemwegsobstruktion
- 3.4.3.1 Reversibilitätstestung
- 3.4.3.2 Belastungsinduzierte Obstruktion
- 3.4.4 Weiterführende Diagnostik
- 3.4.4.1 Bodyplethysmographie (Ganzkörperplethysmographie)
- 3.4.4.2 EKG und Echokardiographie
- 3.4.4.3 Röntgen der Thoraxorgane
- 3.4.4.4 Metacholin-/ Histamintestung
- 3.4.4.5 CO-Transferfaktor
- 3.4.4.6 Kutane Allergiediagnostik
- 3.5 Messung von bronchialer Obstruktion und Hyperreagibilität
- 3.5.1.H Fluss-Volumen-Diagramm
- 3.5.2.H Bestimmung von Atemwegswiderstand und spezifischer Atemwegsleitfähigkeit
- 3.5.3.H Metacholinprovokation im 5-Stufen-Test
- 3.5.4.H Bronchiale Hyperreagibilität
- 3.5.5.H Bronchiale Obstruktion
- 3.6 Asthmadiagnose bei Kindern
- 3.6.1 Empfehlungen – Asthmadiagnostik beim Kind
- 3.6.1.1 Hinweise auf Differentialdiagnosen bei Kindern
- 3.6.2 Risikofaktoren und Prognose des kindlichen Asthma bronchiale
- 3.6.3 Lungenfunktion (bei Kindern)
- 3.6.4 Indikationen für eine Überweisung eines Kindes zum Facharzt
- 3.7 Einschätzung des Schweregrades und des Risikos des Asthmas
- 3.7.1 Schweregradeinschätzung des Asthma bronchiale
- 3.7.2 Risikopatienten
- 4. Therapie
- 4.1 Therapieziele
- 4.2 Nichtmedikamentöse Therapie
- 4.2.1 Prophylaxe
- 4.2.2 Alternativmedizin und diätetische Ansätze
- 4.2.2.1 Alternativmedizin
- 4.2.2.1.H Hintergrund: Alternativmedizinische Therapieansätze
- 4.2.2.2 Diätetische Maßnahmen
- 4.3 Patientenschulung
- 4.3.1 Inhalte einer Patientenschulung
- 4.3.1.1 Checkliste 1: Durchführung einer strukturierten Asthmaschulung
- 4.3.1.2 Checkliste 2: Inhalte einer strukturierten Asthmaschulung
- 4.3.1.3 Aufklärung über Diagnose und Behandlung
- 4.3.1.4 Schulung über einzuleitende Sofortmaßnahmen beim akuten Asthma
- 4.3.1.5 Schulung nach der Exazerbation
- 4.3.3 Hintergrundinformationen: Schulungsmaterial
- 4.3.3.H Printmedien, Multimedia, Internet
- 4.3.4 Personalisierter Behandlungsplan
- 4.3.5 Empfehlungen – Patientenschulung
- 4.3.6 Compliance
- 4.3.6.1 Einschätzung der Compliance
- 4.3.6.2 Regelmäßiger Gebrauch von Langzeittherapeutika
- 4.3.6.3 Regelmäßige Peak-flow-Kontrollen
- 4.3.6.4 Interventionen zur Förderung des regelmäßigen Gebrauchs von Langzeittherapeutika
- 4.3.6.5 Checkliste 3: Praktische Tipps Therapiecompliance und Patientenverständnis
- 4.4 Pharmakotherapie des Asthma bronchiale
- 4.4.1 Therapieregime
- 4.4.1.1 Stufenschema
- 4.4.1.1.1 Stufe 1 (intermittierendes Asthma)
- 4.4.1.1.2 Stufe 2 (persistierendes leichtes Asthma)
- 4.4.1.1.3 Stufe 3 (persistierendes mittelgradiges Asthma)
- 4.4.1.1.4 Stufe 4 (persistierendes schweres Asthma)
- 4.4.1.2 Therapiedeeskalation
- 4.4.1.3 Empfehlungen – Stufentherapie
- 4.4.2 Wirkstoffklassen
- 4.4.2.1 Langzeittherapeutika (Controller)
- 4.4.2.1.1 Inhalative Steroide
- 4.4.2.1.2 Langwirksame Beta2-Sympathomimetika
- 4.4.2.1.4 Langzeittherapeutika (Controller): Neuheiten in der Pharmakotherapie
- 4.4.2.2 Bedarfstherapeutika (reliever)
- 4.5 Spezielle Behandlungssituationen
- 4.5.1 Beginnender Asthmaanfall (Asthmaexazerbation)
- 4.5.2 Belastungsinduziertes Asthma bronchiale
- 4.5.3 Rhinitis
- 4.5.4 Allergische Bronchopulmonale Aspergillose (ABPA)
- 4.5.5 Gastroösophagealer Reflux
- 4.5.6 Aspirinintoleranz
- 4.6 Auswahl von Inhalationssystemen zur Medikamentenverabreichung
- 4.6.1 Inhalationssysteme, Allgemeine Aspekte
- 4.6.2 Inhalationssysteme, Patientenschulung
- 4.6.3 Inhalationssysteme, Aerosoldeposition
- 4.6.4 Verfügbare Inhalationssysteme
- 4.6.4.1 Treibgasgetriebene Dosieraerosole (pMDI)
- 4.6.4.2 Inhalationshilfen (Spacer)
- 4.6.4.3 Pulverinhalationssysteme (DPI)
- 4.6.4.4 Düsenvernebler
- 4.6.4.5 Ultraschallvernebler
- 4.6.4.6 Inhalationssysteme, Auswahlkriterien
- 4.6.4.8 Empfehlungen - Auswahl von Inhalationssystemen
- 4.6.4.9 Applikation von Beta2-Sympathomimetika
- 5. Besonderheiten (Asthma und Schwangerschaft, Geburt und Kindheit)
- 5.1 Asthma während der Schwangerschaft
- 5.1.1 Einfluss der Schwangerschaft auf die Asthmaerkrankung
- 5.1.2 Behandlung des akuten Asthmas während der Schwangerschaft
- 5.1.3 Pharmakotherapie des Asthma bronchiale während der Schwangerschaft
- 5.2 Asthma unter der Geburt
- 5.3 Medikamentöse Behandlung während der Stillzeit
- 5.3.1 Zusammenfassung: Medikamentöse Behandlung während Schwangerschaft und Stillzeit
- 5.4 Asthma bei Kindern
- 5.4.1 Notfallbehandlung des Asthmas im Kindesalter
- 5.4.1.1 Schweregradeinschätzung
- 5.4.1.2 Notfalltherapie des Asthmas im Kindesalter (> 2 Jahre)
- 5.4.2 Akutes Asthma bei Säuglingen und Kleinkindern (< 2 Jahre)
- 6. Notfallbehandlung des Asthma bronchiale
- 6.1 Studien zu tödlichen oder beinahe tödlichen Asthmaanfällen
- 6.1.1.H Schweregrad der Erkrankung
- 6.1.2.H Medizinische Behandlung
- 6.1.3.H Patientenverhalten und psychosoziale Faktoren
- 6.1.3.1.H Tabelle Erhöhtes Risiko für fast-tödlichen (‚near fatal‘) oder tödlichen Asthmaanfall
- 6.1.4.H Jahreszeit
- 6.1.5.H Vorhersagbarkeit und Prävention von schweren Asthmaanfällen
- 6.2.1 Erkennen des akuten Asthmaanfalls
- 6.2.2 Selbstbehandlung von Patienten mit akutem oder unkontrolliertem Asthma
- 6.2.3 Kennzeichen des akuten Asthmas
- 6.2.4 Akutes Asthma: Patientenschulung und Sofortmaßnahmen
- 6.2.5 Akutes Asthma: Notrufe
- 6.2.6 Akutes Asthma: Schweregradeinschätzung
- 6.3 Klassifizierung des Asthmaanfalls anhand des klinischen Schweregrads
- 6.3.1 Unkontrolliertes Asthma
- 6.3.1.1 Leichtes unkontrolliertes Asthma
6.3.1.2 Mittelschweres unkontrolliertes Asthma
6.3.1.3 Schweres unkontrolliertes Asthma
6.3.1.4 Lebensbedrohliches und “Near Fatal” Asthma
6.3.1.5 Übersicht: Akuter schwerer oder lebensbedrohlicher Asthmaanfall
6.3.1.6 “Brittle Asthma”
- 6.4 Hyperventilationssyndrom
- 6.5 Einschätzen der Erkrankungsschwere
- 6.6 Präklinisches Management
- 6.6.1 Kriterien zur stationären Einweisung / Aufnahme
- 6.6.1.1 Inhalt der stationären Einweisung
- 6.6.2 Untersuchungsablauf
- 6.6.3 Indikation zur stationären Einweisung
- 6.6.3.1 Indikation zur sofortigen stationären Einweisung
- 6.6.3.2 Großzügige Indikationsstellung zur Krankenhauseinweisung
- 6.6.4 H Umgang mit Notrufen
- 6.7 Medikamentöse Therapie des akuten Asthmaanfalls beim Erwachsenen
- 6.7.1 Sauerstofftherapie
- 6.7.1.H Besonderheiten der Sauerstofftherapie bei chronisch obstruktiver Lungenerkrankung (COPD)
- 6.7.2 Beta2-Sympathomimetika
- 6.7.3 Systemische Steroide
- 6.7.4 Weitere medikamentöse Therapie
- 6.8 Verlegung auf die Intensivstation
- 6.9 Weitere Untersuchungen und Verlaufskontrolle
- 6.10 Behandlungsprotokolle
- 6.11 Krankenhausentlassung und Verlaufskontrolle
- 6.11.1 Entlassungszeitpunkt
- 6.11.2 Patientenschulung nach Krankenhausentlassung
- 6.11.3 Verlaufskontrolle (Follow-up)
- 7. Casemanagement, Praxismanagement
Hintergrundinformationen: Praxisorganisation, Qualitätssicherung und Versorgungsschnittstellen 7.H - 7.H Praxisorganisation und Qualitätssicherung für die Betreuung von Asthmapatienten
- 7.1.H Patientenkartei (-datenbank)
- 7.1.1.H Patientenkartei: Identifikation von Patienten
- 7.1.2.H Patientenkartei: ‚Aktives‘ und ‚inaktives‘ Asthma bronchiale
- 7.2.H Spezielle Patientengruppen
- 7.3.H Wiedereinbestellungen, Verlaufskontrollen
- 7.3.1.H Wiedereinbestellungen: Häufigkeit
- 7.3.2.H Wiedereinbestellungen: Organisation
- 7.4.H Datenerhebung
- 7.5.H Praxisausstattung
- 7.6.H Notfälle
- 7.7.H Aufgabenverteilung in der Allgemeinpraxis
- 7.7.1.H Die Rolle des nichtärztlichen Personals (Asthmatrainer)
- 7.7.2.H Voraussetzungen Asthmasprechstunde
- 7.8.H Qualitätssicherung
- 7.9.H Akute Exazerbationen
- 7.10.H Standardisierung von Daten
- 7.10.1.H Datenerhebung und Informationstechnologie
- 7.11.H Empfehlungen – Praxisorganisation und Qualitätssicherung
- 7.12.H Zusammenarbeit mit Fachärzten und Krankenhaus
- 7.12.1.H Überweisung zum Pneumologen
- 7.12.2.H Fachschwestern/ -Pfleger in der pulmonologischen Betreuung
- 7.12.3.H Krankenhauseinweisung
- 7.12.2.H Krankenhausentlassung (Arztbrief)
- 8. Impressum, Quellenangaben
- 8.1. Leitlinie Asthma
- 8.1.1 Evaluation
- 8.1.2 Implementierung / Disseminierung
- 8.1.3 Literaturrecherche
- 8.2 Patientenleitlinie
- 8.3 Finanzierung, Copyright, Disclaimer für die Leitlinie Asthma
1. Einleitung
1.1 Asthma Versorgungsproblem
Mortalität:
Die Mortalität von fünf- bis 44-jährigen Asthmatikern liegt in Deutschland höher als im
restlichen Europa (0,83 vs. 0,59 pro 100 TSD Einwohner) [18]
Nach dem Gutachten des Sachverständigenrates für die Konzertierte Aktion im Gesundheitswesen (2000 und 2001) bestehen Defizite in folgenden Bereichen [506]: Prävention:
Unzureichende Eltern-Beratung in “Atopikerfamilien” (Stillen, Rauchen)
Unzureichende Beratung von Atopikern zu häuslicher und beruflicher
Allergenvermeidung (Hausstaub, Tierhaare...) Diagnostik und Therapie:
Unzureichende Qualität der Indikationsstellung und Durchführung der ärztlichen Allergiediagnostik
Unzureichende Anzahl und Qualität der subkutanen Hyposensibilisierungen Patientenschulung:
Schulung erfolgt zu selten, für die falschen
Personengruppen oder z. T. mit unangemessenen Verfahren (z. B. für Jugendliche) Pharmakotherapie:
Zu seltener Einsatz von inhalativen Kortikosteroiden oder anderen antiinflammatorischen Substanzen (Inhalative Kortikoide nur 33% Anteil am “Gesamtmarkt bronchiale Therapie”) [18].
Zu häufiger, nicht dem Schweregrade der Erkrankung angepasster oder nicht leitliniengerechter Einsatz von Xanthinderivaten, kurzwirksamen inhalative Beta2-Sympathomimetika und Mukolytika.
Unzureichende Umsetzung der evidenzbasierten Therapieleitlinien.
1.2 Adressaten (Zielgruppe) der Leitlinie, Ausschlusskriterien
Die Kernelemente dieser Leitlinie sind auf die ambulante und hausärztliche Versorgung fokussiert. Daneben enthält die Leitlinie aber auch Themen, die sich auf die angrenzenden ärztlichen (insbesondere Lungenfachärzte) und nichtärztlichen Berufsgruppen beziehen. Die für die Patientenversorgung weniger
relevanten Themen wurden unter Hintergrundinformationen (H) zusammengefasst. Die Leitlinie bezieht sich auf Patienten mit Symptomen, die für ein Asthma bronchiale
sprechen und solche, bei denen ein Asthma bereits diagnostiziert wurde. Eine Altersbegrenzung der Zielgruppe besteht nicht. Die Notfallbehandlung des Asthmas ist eingeschlossen. Es bestehen folgende Ausschlusskriterien: - Chronisch obstruktive Atemwegserkrankungen (COLD, COPD)
- Restriktive Atemwegserkrankungen
- Andere, nicht-asthmatische Atemwegserkrankungen
1.3 Ziele dieser Leitlinie
Diese Leitlinie soll dazu beitragen,
- den Erkrankten Zugang zu wissenschaftlich begründeten, angemessenen, wirtschaftlichen und qualitätsgesicherten Verfahren der Diagnostik, Prävention, Behandlung und Rehabilitation zu garantieren.
- die Qualität und Sicherheit der Diagnosestellung zu verbessern.
- Symptome des Asthmas innerhalb eines adäquaten Zeitraumes zu minimieren.
- die Lebensqualität der Asthmakranken zu verbessern.
- Komplikationen, Rezidive und Chronifizierungen zu vermeiden.
- Nebenwirkungen und Folgeerscheinungen der Therapie zu minimieren.
- eine Senkung der Erkrankungshäufigkeit, des Krankenstandes, der Morbidität und Mortalität und der daraus resultierenden sozialen und gesamtwirtschaftlichen Folgen zu erreichen.
1.4 Einteilung der Empfehlungsklassen und Evidenzstärken
Die Empfehlungen der Leitlinie sind - ihrer Relevanz entsprechend - in 3 Stufen (A, B, C) eingeteilt, die durch die Stärke der zugrunde liegenden Evidenz charakterisiert werden. Soweit möglich, wird die zugrunde liegende Quelle angegeben. Nähere Einzelheiten finden Sie unter ”Einteilung der Empfehlungsklassen und Evidenzstärken” 1.4.H [20].
1.5 Wichtigste Quellen dieser Leitlinie: siehe Referenzen link
2. Definitionen, Ätiologie, Komplikationen des Asthma bronchiale
2.1 Definition und Charakteristik
Der International Consensus Report beschreibt Asthma als “chronisch entzündliche Erkrankung der Atemwege ... die entzündlichen Symptome führen bei den Betroffenen zu einer variablen Behinderung des Luftstromes in den Atemwegen und zu einer Zunahme der Sensibilität der Atemwege
für eine Vielzahl von Stimuli. Die bronchiale Obstruktion ist oftmals reversibel, entweder spontan oder durch eine Behandlung” [586]. Es besteht damit eine variable und reversible Atemwegsobstruktion infolge Entzündung und Hyperreaktivität
der Atemwege [403].
Charakteristisch für Asthma sind vorübergehende oder dauerhafte Symptome wie Luftnot, Engegefühl in der Brust, pfeifende Atmung, erhöhte Sputumproduktion und Husten. Gleichzeitig besteht eine wechselnd starke
Einschränkung des bronchialen Luftstroms (Airflow) und eine wechselnd ausgeprägte Hyperreagibilität der Atemwege auf endogene und exogene Stimuli.
Bei der Entstehung und der Manifestation des Asthmas spielen ein meist eosinophiler Entzündungsprozess und seine Einflüsse auf die Atemwegsstruktur eine Schlüsselrolle. Daher setzt auch eine effektive Asthmatherapie bei einer Begrenzung der auslösenden Faktoren (Trigger) einerseits und einer Eingrenzung des Entzündungsprozesses andererseits an.
Zusätzlich werden dann bei Bedarf Therapeutika eingesetzt, die die Atemwege erweitern und die Symptome vermindern.
Dazu muss der individuelle Bedarf an therapeutischen Interventionen ermittelt werden. Für jeden Patienten fällt die Risiko-Nutzen-Abwägung der therapeutischen Interventionen (Pharmakotherapie, Änderung der Umwelteinflüsse, Schulung) unterschiedlich aus [66]. Für die Diagnose des Asthma bronchiale gibt es keinen Goldstandard [454]. Die Diagnose basiert auf der Anamnese und den klinischen Symptomen und wird durch apparative Untersuchungen unterstützt. Für sich allein betrachtet ist kein Kriterium wegweisend [190, 454].
Im klinischen Alltag empfiehlt es sich im Gegensatz zu wissenschaftlichen Untersuchungen, für die Diagnose weniger strenge Kriterien anzulegen. Für den Kliniker ist es wichtig, die Patienten zu identifizieren, die von der Behandlung oder einem
Behandlungsversuch profitieren [454]. Es gibt Überlappungsbereiche von chronisch obstruktiver Lungenerkrankung (COPD) und Asthma bronchiale, die Differenzierung zwischen diesen Krankheitsbildern ist nicht immer möglich [334]. 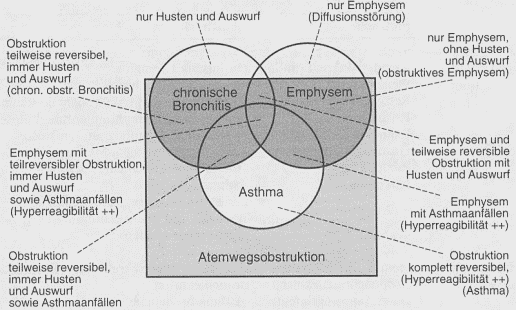 |
Abbildung 1: Schematische Darstellung der obstruktiven Atemwegserkrankungen mit Überlappung der drei großen Entitäten: Asthma, Emphysem und Bronchitis. Der schraffierte Bereich entspricht
der von der American Thoracic Society vorgeschlagenen Definition der COPD (chronic obstructive pulmonary disease) (nach Köhler 1995 [304]).
2.2 Epidemiologie Asthma ist eine häufige Erkrankung, deren Variabilität des klinischen Erscheinungsbildes Prävalenzangaben erschwert bzw. relativiert. Die Hyperreagibilität des Atemwegssystems geht fließend in asthmatische Reaktionen über.
Angaben zur Prävalenz in Deutschland: Etwa 5% der Erwachsenen und 8 – 12% der Kinder, mit
starken regionalen Unterschieden. Damit ist Asthma bronchiale die häufigste chronische Erkrankung im Kindesalter [18, 29, 34]. Die in den vergangenen Jahrzehnten beobachtete starke
Prävalenzzunahme bei Kindern und Jugendlichen scheint derzeit zum Stillstand zu kommen. Auch weiterhin besteht Unklarheit über die Ursachen der Prävalenzzunahme: Diskutiert werden Einflüsse durch westlich-zivilisierte Wohnverhältnisse und Ernährungsgewohnheiten, seltenere Infektionsexposition kleinerer Kinder, unkritischen Antibiotikaeinsatz, zunehmende Allergenexposition und vorzeitiges Abstillen.
Asthma ist eine chronische, meist lebenslang bestehende Erkrankung, die das Befinden, die Leistungsfähigkeit und die Lebensqualität erheblich beeinträchtigen kann.
Mortalität bei fünf – bis 44-jährigen Asthmatikern: 0,83 pro 100 TSD Einwohner. Laut Totenschein-Statistik sterben in Deutschland 4000 – 5000 Menschen/Jahr an Asthmafolgen [34].
2.3 Ätiologie, Asthmaformen
Eine strenge Klassifikation des Asthmas nach ätiologischen Kriterien ist nicht immer sinnvoll, da
sich die verschiedenen Formen oft überschneiden. Eine mögliche Einteilung orientiert sich an der allergischen oder nichtallergischen Genese [34]: - Extrinsisches (IgE-vermitteltes), allergisches Asthma durch Allergene in Umwelt oder
Arbeitswelt
- Intrinsisches (nicht IgE-vermitteltes), nichtallergisches Asthma durch
- Infektion
- Toxische oder chemisch-irritative Stoffe
- Gastroösophagealen Reflux
- Anstrengung (bes. Kinder und Jugendliche)
- Pseudoallergische Reaktion (Analgetika)
- Mischformen aus beiden (gemischtförmiges oder ‚mixed‘ Asthma)
2.4 Ursachen, Risikofaktoren, Prävention
Asthma tritt familiär gehäuft auf, bedingt wohl durch genetische Faktoren. Asthma gehört zu den atopischen Krankheiten wie allergische Rhinitis und Neurodermitis. Die Erkrankung manifestiert sich also meist bei Kindern, deren Eltern oder Geschwister an Asthma oder anderen
atopisch-allergischen Erkrankungen leiden. Wie bei anderen atopischen Erkrankungen steigt das Risiko, wenn beide Elternteile erkrankt sind [332].
Die Asthmasymptomatik verschlechtert sich durch Trigger (Auslöser) oder, meist infektiöse,
Zweiterkrankungen. Spezifische Trigger (z.B. Allergene) gelten als ursächlich in der Asthmaentwicklung, ein fortgesetzter Kontakt verschlechtert den Krankheitsverlauf. Unspezifische (nicht kausale) Trigger können nur auf dem Boden eines hyperreagiblen Bronchialsystems eine Obstruktion auslösen. Die pathogenetische Potenz der Trigger ist interpersonell unterschiedlich, das heißt, ein Trigger kann bei
verschiedenen Individuen unterschiedliche Reaktionen auslösen. Die Vermeidung von Triggern kann den Krankheitsverlauf verbessern [34, 5]. Die möglichen Trigger sind aufgeführt unter 3.2.1.1.
2.5 Prognose, mögliche Komplikationen (Abwendbar gefährliche Verläufe)
Bei leichtem Asthma besteht unter adäquater Therapie insgesamt eine gute Prognose [312]. Ein erhöhtes Morbiditäts- und Mortalitätsrisiko besteht bei etwa 5% der Patienten [311], im Wesentlichen bedingt durch pulmonale Folgeerkrankungen. Eine Studie zeigte ein 1,5-fach erhöhtes Sterberisiko für Männer und ein 1,7-fach erhöhtes Sterberisiko für Frauen verglichen mit Personen ohne Asthma über 17 Jahre [312]. Bekannte Komplikationen (Abwendbar gefährliche Verläufe) sind: - Asthmaanfall (Exazerbation des Asthmas) mit Entwicklung zu
Status asthmaticus und/oder respiratorischer Insuffizienz
- Entwicklung einer chronischen Obstruktion/ eines Lungenemphysems
- Entwicklung einer pulmonalen Hypertonie bei Cor pulmonale
2.6 ICD-Klassifikation [147]
- J45 Asthma bronchiale
Exkl.: Akutes schweres Asthma bronchiale (J46)
Chronische asthmatische (obstruktive) Bronchitis (J44.-)
Chronisches obstruktives Asthma bronchiale (J44.-)
Eosinophiles Lungeninfiltrat mit Asthma bronchiale (J82)
Lungenkrankheiten durch exogene Substanzen (J60-J70)
Status asthmaticus (J46)
- J45.0 Vorwiegend allergisches Asthma bronchiale
Allergische:
- Bronchitis o.n.A.
- Rhinopathie mit Asthma bronchiale
Atopisches Asthma
Exogenes allergisches Asthma bronchiale (Extrinsisches Asthma)
Heuschnupfen mit Asthma bronchiale
- J45.1 Nichtallergisches Asthma bronchiale
Endogenes nichtallergisches Asthma bronchiale (Intrinsisches Asthma)
Medikamentös ausgelöstes nichtallergisches Asthma bronchiale (Analgetika-Asthma)
- J45.8 Mischformen des Asthma bronchiale
Kombination von Krankheitszuständen unter J45.0 und J45.1
- J45.9 Asthma bronchiale, nicht näher bezeichnet
Asthmatische Bronchitis o.n.A.
Late-Onset-Asthma
- J46 Status asthmaticus
Akutes schweres Asthma bronchiale
3. Diagnosestellung des Asthmas
Neben Asthma und COPD können auch andere Erkrankungen wie Infektionen, restriktive Lungenerkrankungen, Herzinsuffizienz und rezidivierende Lungenembolien Luftnot verursachen.
Daher sollten bei Symptomen wie Husten, Giemen und Atemnot objektive Bestimmungen der Atemwegsobstruktion durchgeführt werden. Die Atemwegsobstruktion selbst kann generalisiert (Asthma, COPD, Bronchiektasen, Zystische Fibrose, Bronchiolitis obliterans) oder lokalisiert (Tumor, Fremdkörper, Trachealstenose oder Stimmritzendysfunktion (vocal cord dysfunction) ) vorliegen [551].
3.1 Symptome des Asthmas
Asthmatiker können eine Vielzahl von Symptomen aufweisen, von denen keines spezifisch für die
Erkrankung ist: - Husten
- Giemen
- Kurzatmigkeit
- Enge in der Brust
Kennzeichnend für das Asthma ist, dass diese Symptome
- variierend
- intermittierend
- in der Nacht (oft 4 – 6 Uhr) verstärkt und
- ausgelöst durch Trigger, auch Anstrengung,
auftreten können. Ist Husten das Hauptsymptom, ohne dass Giemen gehört werden kann, spricht man von der ‘Husten-Variante‘ des Asthma bronchiale. Während einer Krankheitsexazerbation finden sich meist Giemen und eine Einschränkung der
Lungenfunktion (eingeschränkter Peak-flow oder obstruktive Veränderungen des Fluss-Volumen-Diagramms). Das Giemen (meist beidseitig, diffus, polyphon und insbesondere expiratorisch) ist ein Hauptmerkmal des Asthma bronchiale. Das Vorhandensein von Giemen sollte daher stets dokumentiert werden. - => Giemen sollte stets in der Patientenkartei dokumentiert werden.
3.2 Basisdiagnostik
3.2.1 Anamnese
Asthmasymptome können isoliert oder in unterschiedlicher Kombination auftreten. Zum Zeitpunkt
der Untersuchung kann der Patient auch vollkommen symptomfrei sein.
Zu fragen ist auch nach typischen Symptomen: - Hustet der Patient (das Kind) am Tag oder in der Nacht ? Erbricht er (es) sich dabei?
- Tritt hin oder wieder eine pfeifende Atmung (Giemen) auf?
- Besteht gelegentlich ein Engegefühl um die Brust?
- Ist der Patient rasch außer Atem? Tritt dies unter Belastung oder auch in Ruhe auf?
- Wacht der Patient nachts oder in den frühen Morgenstunden wegen Luftnot oder Husten auf?
- Besteht eine Abhängigkeit der Atemwegsbeschwerden von der Witterung?
- Besteht ein saisonales Auftreten von Atemwegsbeschwerden (z.B. Pollenflug, siehe 3.2.1.H)?
- Besteht eine vermehrte Empfindlichkeit gegenüber scharfen Gerüchen (Parfüm, Haarspray, Anbraten von Speck, Benzingeruch, Tabakrauch etc.)?
- Treten Luftnot oder Husten beim Staubsaugen oder Betten machen auf?
Weitere Fragen geben gelegentlich Hinweise zur Asthmadiagnose: - Leidet in der Familie sonst jemand an Asthma oder Atemwegsbeschwerden?
- Leidet der Patient selbst an Allergien oder Heuschnupfen?
- Hat der Patient in der Kindheit an Milchschorf gelitten?
- Besteht eine Neurodermitis?
- Hat der Patient selbst auslösende Faktoren seiner Atemnot oder der pfeifenden Atmung (Giemen) bemerkt, z.B. Virusinfekt, Anstrengung, Allergenkontakt, Medikamente (z. B. Schmerzmittel wie Aspirin oder Betablocker)?
Typische Allergene im Verlauf der Jahreszeiten siehe 3.2.1.H
3.2.1.1. Anamnestische Erhebung möglicher Trigger [92]:
Allergene: häufiger und wichtiger Trigger. Dazu gehören: - Pollen
- Hausstaubmilbenkot
- tierische Allergene (Hautschuppen von Pelztieren wie z.B. Katzen oder Hunden)
- Federn
- Schimmelsporen
- Nahrungsmittelallergene
- bestimmte Medikamente
- Insekten- Allergene, z.B. von Kakerlaken (Cockroach Allergens)
Infektionen: virale und bakterielle Atemwegsinfektionen Körperliche Anstrengung:
Bei etwa 80% der Asthmatiker treten unter Belastung Atemwegsbeschwerden auf. Gelegentlich sind Kurzatmigkeit, Husten oder thorakales Engegefühl bei Belastung die einzigen Symptome eines Asthmas. Medikamente: Jede Verschlechterung der Asthmasymptomatik durch eine neue Medikation (auch eine komplementärmedizinische) sollte genau beobachtet werden. Besonders ungünstig können folgende Pharmaka wirken: - Beta-Blocker, auch als Augentropfen
- Aspirin und andere NSAR
- Naturheilkundliche Präparate wie Gelee royale und Echinacea
Nahrungsmittelunverträglichkeit: Nahrungsmittelunverträglichkeit kann entweder als IgE-abhängige Allergie (gegen Nüsse, Fisch, Milch, Eier...) auftreten oder als “chemische Intoleranz”, auch gegen Zusatzstoffe. Gastroösophagealer Reflux: Bei einigen Asthmatikern können Mikro-Aspirationen oder
Reflux von Magensäure einen Bronchospasmus auslösen. Psychische Faktoren: Auch emotionale Trigger wie Angst oder Stress können eine Asthmasymptomatik verschlechtern. Reizstoffe (Irritants): Zigarettenrauch, ob selbst inhaliert oder aus der Umgebung eingeatmet, kann Asthma verschlechtern.
Luftverschmutzung ist nicht die Ursache, aber häufig Auslöser von Asthmaanfällen.
Farb-Dämpfe, Dünste von Haushaltsreinigern und Geruchsstoffe in Kosmetika können ebenfalls Asthma auslösen. Triggerfaktoren am Arbeitsplatz: Dazu gehören: Stäube, Gase, Labortiere, Mehl und industrielle Chemikalien. Temperaturänderungen:
Kalte Umgebungstemperaturen und Temperaturabfälle können Asthmaanfälle triggern.
3.2.2 Körperliche Untersuchung
Zum Zeitpunkt der Untersuchung kann der Patient vollkommen frei von krankhaften Befunden sein.
Die aufgezählten Befunde können auch bei anderen Atemwegserkrankungen (z.B. Emphysem, COPD) vorliegen. Zu achten ist auf hochfrequente Atemnebengeräusche (Pfeifen und Giemen) und niederfrequente Geräusche (Brummen). Zusätzlich kann Sekret in den großen Atemwegen zu Rasselgeräuschen führen.
3.2.3 Empfehlungen – Anamnese und körperliche Untersuchung
Die Anamnese sollte typische Symptome, die persönliche und familiäre Risikokonstellation asthmatischer und atopischer Erkrankungen und triggernde Substanzen bzw. Situationen abfragen. (C) Die körperliche Untersuchung umfasst, neben der Beobachtung der Zeichen für akute oder chronische Ateminsuffizienz, eine bronchiale Auskultation mit Fokus auf Nebengeräusche und verlängertes Expirium. Der „Anhusteversuch“ kann dabei hilfreich sein. (C)
3.3. Laboruntersuchungen
Die Erstdiagnose des Asthmas ist in erster Linie eine klinische Diagnose, die gestützt wird durch die Lungenfunktionsuntersuchungen. Laboruntersuchungen sind primär nicht erforderlich, können aber im Zweifelsfall hilfreich sein:
Zur Erstdiagnose Asthma kann in wenigen Fällen die Untersuchung der Eosinophilen im Blutbild,
des Gesamt-IgE (Nachteil = muss nicht erhöht sein), des spezifischen IgE (relativ teuer) hilfreich sein. Auch die Ursache einer Exazerbation ist in erster Linie durch eine sorgfältige Anamnese zu klären. Bei entsprechenden Hinweisen können zur Klärung einer Exazerbation (viraler / bakterieller Infekt) hilfreich sein: - Blutbild (Leukozyten, Differentialblutbild)
- BSG
- CRP (qualitativ oder besser quantitativ, schnell verfügbar)
Wenn möglich, sollte die Sauerstoffsättigung bei allen Formen der Atemnot bestimmt werden.
Liegt die Sauerstoffsättigung < 92 % oder finden sich andere Zeichen für einen akuten Asthmaanfall, kann eine Blutgasanalyse zur Einschätzung des Schweregrades und zur Abgrenzung gegenüber der COPD sinnvoll sein [65, 73, 95, 390, 396, 546]. Die Blutgasanalyse kann außerdem bei der Differentialdiagnose (psychogene Hyperventilation,
metabolische Azidose, Hinweis auf Lungenembolie, Globalinsuffizienz bei Erschöpfung der Atempumpe) hilfreich sein. Weitere Laboruntersuchungen siehe 3.3.H
3.3.1 Empfehlungen Laboruntersuchungen
Laboruntersuchungen gehören nicht zur Routinediagnostik des Asthmas. (C)
Bei Unklarheiten bei der Erstdiagnose können Eosinophilen im Blutbild und Gesamt-IgE hilfreich sein. (C) Bei einer Exazerbation können Blutbild (Leukozyten, Differentialblutbild), BSG und/oder CRP zur Klärung der Ursache beitragen. (C)
3.4 Technische Untersuchungen
Obstruktive Atemwegserkrankungen führen zu einem Rückgang des peak expiratory flow (PEF) (siehe 3.4.2 Peak-flow-Messung) und des forcierten expiratorischen Volumens in einer Sekunde (FEV1 ) (siehe 3.4.1 Spirometrie). Die Werte können jedoch unauffällig sein, wenn sie zwischen
bronchospastischen Episoden gemessen wurden. Unter diesen Umständen kann eine mehrmalige tägliche Peak-flow-Messung mit Protokollierung der Werte in einem Diagramm zur Diagnosesicherung beitragen. Wiederholt unauffällige Werte bei gleichzeitigem Vorliegen asthmatischer Symptome stellen die Richtigkeit der Diagnose Asthma in Frage.
3.4.1 Spirometrie
Die Spirometrie wird auch als ‚kleine Lungenfunktion‘ bezeichnet. Sie kann auch in der Allgemeinarztpraxis mit Handgeräten durchgeführt werden. Die wichtigsten hierbei erhobenen Werte sind die Vitalkapazität (VC) und die Einsekundenkapazität (FEV1). Die Einsekundenkapazität dient als Verlaufsparameter. Beim Vorliegen einer bronchialen Obstruktion findet man eine Reduktion der Einsekundenkapazität
(FEV1) bei erhaltener Vitalkapazität. Der Quotient von FEV1/FVC (Tiffeneauindex) ist somit reduziert (< 70%). Die Einsekundenkapazität unterliegt den gleichen Schwankungen wie der Peak-flow-Wert.
Bei Symptomfreiheit kann die Lungenfunktion vollständig unauffällig sein. Werden jedoch mehrmals trotz des Vorliegens von Symptomen unauffällige Spirometerkurven aufgezeichnet, ist die Asthmadiagnose zu hinterfragen. Ein häufiges Kennzeichen des Asthma bronchiale ist die
Überblähung der Lunge, bei normaler oder erniedrigter VC ist die TLC erhöht. Oft besteht die Überblähung auch zwischen einzelnen bronchospastischen Episoden fort. Diagnostiziert werden kann sie allerdings nur bodyplethysmographisch. Weitere Hintergrundinformationen: 3.5.1.H
3.4.1.1. Empfehlungen Spirometrie
=> Ein Spirometer sollte in jeder Hausarztpraxis vorhanden sein. => Vor Therapiebeginn sollte eine Spirometrie zur Diagnosesicherung durchgeführt werden.
3.4.2 Peak-flow-Messung (PEF)
Die regelmäßige Messung des expiratorischen Spitzenflusses (Peak-flow, PEF) ist im ambulanten Bereich eine geeignete Möglichkeit, die Lungenfunktion eines Asthmatikers zu überwachen. Die Messung kann bei der Diagnosestellung des Asthma bronchiale helfen und ist im Krankheitsverlauf für die Therapiesteuerung unverzichtbar [247, 407, 456].
Standard in der Diagnostik des Asthmas ist allerdings die Lungenfunktionsprüfung (3.4.1). Peak-flow-Messung als Diagnostikum Peak-flow-Messung zur Verlaufs-/Therapiebeurteilung - in der medikamentösen Einstellungsphase (Überprüfung des Therapieeffektes für Arzt und Patient)
- Beurteilung der anhaltenden Stabilität (Erkennung drohender Exazerbation)
- Beurteilung jeder Therapieänderung
Wegen der verschiedenen Einschränkungen der Aussagekraft von Peak-flow-Messungen kann aber
auch eine regelmäßige lungenfunktionelle Kontrolle in der Arztpraxis sinnvoll sein. Die Intervalle sollten dann im Einzelfall festgelegt werden.
3.4.2.1 Normwerte der Peak-flow-Messung
Für die Bestimmung des Peak-flows (PEF) wurden Normwerte und Ableitungsgleichungen
veröffentlicht [409]. Diese Werte gelten für die geeichten klassischen Spirometriemessgeräte, für die nicht eichbaren reinen Peak-flow-Messgeräte zur Verlaufskontrolle lassen sich die Absolutwerte
nicht verwenden, auswertbar sind nur die Varianzen im zeitlichen Verlauf. Ein Nomogramm sollte Standardabweichungen und keine fixen Zielwerte enthalten. In der Praxis sollte dasselbe Nomogramm für alle Patienten verwendet werden. Ein Beispiel findet sich in der Patientenleitlinie Asthma.
Limitation des Peak-flow (PEF) Protokolls siehe 3.4.2.H
3.4.2.2 Diagnosekriterien der Peak-flow-Messung
3.4.2.2.1 Einmalige Peak-flow (PEF)-Messung
Die gelegentliche Bestimmung des Peak-flow (PEF) als Prozent vom Sollwert (mit einem geeichten Gerät) kann beim Verdacht auf ein Asthma bronchiale nützlich sein und ggf. weitere Untersuchungen nach sich ziehen.
3.4.2.2.2 Peak-flow (PEF)-Variabilität
Die zweimal tägliche Messung des Peak-flows (PEF) über zwei Wochen (morgens und nachmittags) ist ein wertvolles diagnostisches Hilfsmittel. Eine Schwankung um mehr als 20 % und mindestens 60 l/min. im Beobachtungszeitraum ist signifikant [244, 247, 456]. Die Variabilität berechnet sich folgendermaßen: (Höchstwert-Tiefstwert)/Höchstwert x 100
Die Spezifität der Peak-flow-Variabilität ist groß, ihre Sensitivität jedoch gering. Dies bedeutet, dass eine geringere Peak-flow-Variabilität eine Asthmadiagnose keinesfalls ausschließt.
3.4.2.2.3 Ansprechen auf die Therapie
Ein Ansprechen auf die Therapie findet sich bei
- einem Anstieg der individuellen Peak-flow (PEF)-Werte
- einer Abnahme der Peak-flow (PEF)-Variabilität
- einem fehlenden Abfall der Peak-flow (PEF)-Werte unter Belastung [430]
- einer Abnahme der Peak-flow (PEF)-Reversibilität nach Bronchodilatation
3.4.2.3 Empfehlungen - Peak-flow (PEF)-Messung
Die regelmäßige Messung des expiratorischen Spitzenflusses (Peak-flow, PEF)
ist die geeignete Möglichkeit, die Lungenfunktion eines Asthmatikers zu überwachen. (B)
Die Messung kann bei der Diagnosestellung des Asthma bronchiale helfen. (B) Die Interpretation von Peak-flow (PEF)-Werten muss mit Vorsicht geschehen. Sie erfordert stets die gemeinsame Betrachtung von klinischen Befunden und Symptomen. (B) In der Praxis sollte stets ein Peak-flow-Meter gleicher Bauart verwendet werden. (C)
Bei Patienten, die kein Peak-flow-Meter benutzen können (Kleinkinder und ältere Menschen), muss das klinische Ansprechen auf die Therapie als Diagnosekriterium gewählt werden. (C) Die Diagnose eines Asthma bronchiale sollte anhand der Peak-flow (PEF)-Variabilität, der Reversibilitätstestung oder des Ansprechens auf die Therapie gesichert werden. (B) => Der Patient sollte die korrekte Technik der Peak-flow-Messung und auch die
Protokollierung in der Praxis erlernen. Die Erfahrung hat gezeigt, dass die Dokumentation viele Patienten vor Probleme stellt. => Jeder Patient sollte sein eigenes, verordnetes Gerät benutzen und immer mit demselben Gerät messen. => Peak-flow-Meter sind verordnungsfähig. => Die Erstdiagnose eines Asthmas sollte hierzulande durch eine
Lungenfunktionsuntersuchung und ggf. weitere differentialdiagnostische pulmonologische Untersuchungen gestellt werden.
3.4.3 Diagnosekriterien der Atemwegsobstruktion
Hierbei können die Peak-flow-Messung (Änderung um 20% bzw. 60 l/min. gegenüber dem
Ausgangswert) und die Einsekundenkapazität (FEV1, Spirometrie siehe 3.4.1) (Änderung um 15% bzw. 200 ml gegenüber dem Ausgangswert) eingesetzt werden.
3.4.3.1 Reversibilitätstestung
Ein Anstieg des Peak-flows (PEF) um 20 % oder der Einsekundenkapazität (FEV1) um 15 % etwa 10 Minuten nach Gabe eines Bronchodilatators (z.B. 400 µg Salbutamol als Dosieraerosol mit Spacer oder 2,5 mg über Vernebler) oder nach Gabe von oralen Steroiden (30 mg Prednisolonäquivalent /Tag über einen Zeitraum von 14 Tagen) sichert die Diagnose eines Asthma bronchiale [454].
3.4.3.2 Belastungsinduzierte Obstruktion
Ein Abfall des Peak-flows (PEF) oder der Einsekundenkapazität (FEV1) um 15 % nach körperlicher Anstrengung weist auf ein Asthma bronchiale hin, eine Reduktion um 20 % sichert die Diagnose eines Asthma bronchiale.[190]
Zunächst wird eine Untersuchung in Ruhe vorgenommen. Danach belastet sich der Patient über 6 Minuten (Laufen oder Fahrradfahren). Im Anschluss daran sowie in weiteren Abständen von 10 Minuten für insgesamt 30 Minuten werden erneut Messungen vorgenommen. Hierbei muss wegen der Gefahr der Auslösung eines akuten Asthmaanfalls unbedingt ein Notfallinstrumentarium vorgehalten werden.
3.4.4 Weiterführende Diagnostik
Die weiterführende Diagnostik dient zur Eingrenzung der Diagnose und zur Abgrenzung von weiteren Erkrankungen. Sie gehört nicht zur Routine und ist teilweise Aufgabe des Spezialisten.
3.4.4.1 Bodyplethysmographie (Ganzkörperplethysmographie)
In der Bodyplethysmographie (große Lungenfunktion) werden neben den spirometrischen Daten auch der zentrale Atemwegswiderstand, das intrathorakale Gasvolumen sowie das Residualvolumen bestimmt. Die Compliance kann durch zusätzliche Verwendung einer Ösophagusballonsonde
bestimmt werden. Hierdurch erhält man Aussagen über den Grad der Lungenüberblähung und das Ausmaß einer zentralen Atemwegsobstruktion. Wesentlicher Vorteil der Ganzkörperplethysmographie ist die Messung des Atemwegruhewiderstandes und der TLC. Erst hierdurch kann bei erniedrigter Vitalkapazität unterschieden werden, ob eine Restriktion, eine Überblähung oder eine Kombination von beidem vorliegt. Der Atemwegsruhewiderstand ist mitarbeitsunabhängig und besitzt daher eine größere Aussagekraft bei eingeschränkter Mitarbeit. Besondere Bedeutung hat hierbei die Änderung nach Broncholyse bzw. Provokation.
Inhomogene Strömungswiderstände lassen sich durch entsprechende Veränderungen der Resitanceschleifen erkennen. Die Untersuchung dient somit beim Asthmatiker vor allem zur Abgrenzung gegenüber der COPD und
dem Lungenemphysem.
Hierbei ist jedoch zu beachten, dass eine COPD ein zusätzlich bestehendes Asthma nicht ausschließt. Die Bodyplethysmographie sollte in der Lungenarztpraxis erfolgen. Weitere Hintergrundinformationen: 3.5.2.H und 3.5.5.H
3.4.4.2 EKG und Echokardiographie
EKG und Echokardiographie dienen der weiteren Diagnostik bei eindeutigem Zweifel an der Verdachtsdiagnose eines Asthma bronchiale. Eine Echokardiographie sollte nur bei richtungsweisendem Verdacht auf eine Herzerkrankung (z.B. dekompensierte Herzinsuffizienz, v.a. koronare Herzerkrankung) veranlasst werden.
3.4.4.3 Röntgen der Thoraxorgane
Zur Asthmadiagnose ist das Röntgenbild nicht hilfreich, insbesondere, wenn die Diagnose durch die o.g. Untersuchungen gesichert werden konnte. Eine Röntgenaufnahme der Thoraxorgane dient der Klärung der Differentialdiagnose Dyspnoe und sollte bei allen Patienten mit atypischen Atemwegssymptomen erfolgen, um Erkrankungen wie das Bronchialkarzinom, das
Lungenemphysem oder die Lungenstauung bei Herzinsuffizienz auszuschließen.
Auch beim akuten Asthmaanfall ergibt sich keine Indikation zur routinemäßigen Röntgenaufnahme der Thoraxorgane (siehe Notfall).
3.4.4.4 Metacholin-/ Histamintestung
Die Messung der bronchialen Empfindlichkeit gegenüber Metacholin oder Histamin kann helfen, eine Asthmadiagnose auszuschließen. Bei Asthmapatienten besteht fast immer eine bronchiale
Hyperreagibilität. Jedoch findet sich auch bei Patienten mit COPD oder Gesunden relativ häufig eine bronchiale Hyperreagibilität. Hiermit hat die Hyperreagibilitätstestung eine niedrige Spezifität und Sensitivität. Hilfreich ist der Nachweis einer bronchialen Hyperreagibilität bei asthmatischem Husten ohne wesentliche Obstruktion, um frühzeitig die Indikation zu einer topischen Steroidtherapie stellen zu können.
In der Praxis ist der Metacholinprovokationstest zudem hilfreich, weil ein negatives Ergebnis ein Asthma bronchiale unwahrscheinlich macht.
Die Hyperreagibilitätsprüfung sollte dem Spezialisten überlassen bleiben. Weitere Hintergrundinformationen: 3.5.3.H
3.4.4.5 CO-Transferfaktor
Die Bestimmung des CO-Transferfaktors kann hilfreich sein, um ein Lungenemphysem auszuschließen.
Auch diese Untersuchung sollte dem Spezialisten überlassen bleiben.
3.4.4.6 Kutane Allergiediagnostik
Ergibt sich aus der Anamnese der Hinweis auf eine allergische Ursache der Beschwerden oder bestehen arbeitsmedizinische Fragestellungen, kann u. U. durch eine allergologische Diagnostik mit
kutaner Allergietestung (Prick-Test) die allergische Komponente weiter abgeklärt werden.
3.5 Messung von bronchialer Obstruktion und Hyperreagibilität
siehe Hintergrundinformationen: 3.5.H - 3.5.1.H Fluss-Volumen-Diagramm
- 3.5.2.H Bestimmung von Atemwegswiderstand und spezifischer Atemwegsleitfähigkeit
- 3.5.3.H Metacholinprovokation im 5-Stufen-Test
- 3.5.4.H Bronchiale Hyperreagibilität
- 3.5.5.H Bronchiale Obstruktion
3.6 Asthmadiagnose bei Kindern
Bei kleinen Kindern ist es oft schwierig, Asthma sicher zu diagnostizieren. Oft ist es nicht
möglich, technische Untersuchungen zur Messung der Atemwegsfunktion durchzuführen und damit eine variable Atemwegsobstruktion nachzuweisen. Daher sollte die Diagnosesicherung durch einen erfahrenen Lungenfacharzt und die notwendigen technischen Untersuchungen erfolgen.
Asthma sollte bei jedem Kind mit pfeifender oder erschwerter Atmung vermutet werden. Der Befund sollte idealerweise auskultatorisch von einem Arzt erhoben werden und von einer Obstruktion der
oberen Atemwege differenziert werden. Bei Schulkindern können zur Diagnosesicherung das Ansprechen auf Bronchodilatatoren, die PEF-Variabilität und Untersuchungen der bronchialen Hyperreagibilität mit den gleichen Einschränkungen wie beim Erwachsenen eingesetzt werden. Allergie-Tests
können bei Suche nach auslösenden Faktoren oder der Abklärung einer Atopie hilfreich sein. Ein Kind mit Asthma muss nicht zwangsläufig unter Allergien leiden, jedoch sollte ihr Fehlern bei Kindern mit Asthmasymptomen Anlass zur Erwägung von Differentialdiagnosen sein.
Manchmal bestätigt erst der erfolgreiche Therapieversuch die Diagnose Asthma. => Viele Eltern glauben, ihrem Kind eine Therapie ersparen zu können, weil das Asthma mit der Pubertät verschwinde. Eine wechselnde Intensität der Asthmasymptome wird für ein Ausheilen der Erkrankung gehalten.
Voraussetzung zur Behandlung eines kindlichen Asthmas ist daher auch eine ausführliche und offene Beratung der Eltern bzw. Erziehungsberechtigten
(siehe auch Patientenleitlinie Asthma)
3.6.1 Empfehlungen – Asthmadiagnostik beim Kind
Die Asthmadiagnose bei Kindern basiert auf (C): Vorhandensein typischer Symptome nach orientierendem Ausschluss der Differentialdiagnosen
Adäquates Ansprechen der Symptome auf eine individualisierte Therapie Regelmäßige Verlaufsuntersuchungen und Infragestellen der Diagnose, wenn ein Ansprechen auf die Therapie ausbleibt.
3.6.1.1 Tabelle: Hinweise auf Differentialdiagnosen bei Kindern
(Symptome, die üblicherweise nicht bei Asthma gefunden werden) [551]
Klinischer Hinweis | Mögliche Ursache
| | Perinatale- und familiäre Vorgeschichte | | Symptome von Geburt an vorhanden oder Atmungsprobleme unter der Entbindung | Zystische Fibrose, chronische Lungenerkrankung, Ziliäre Dyskinesie, Entwicklungsstörung | | familiäre Vorgeschichte einer ungewöhnlichen Lungen-/, Atemwegserkrankung | Zystische Fibrose, Entwicklungsstörung, neuromuskuläre Erkrankung | | Schwere Erkrankung der oberen Atemwege | IgG-Subklassenmangel, Immundefekt | | Symptome und Krankheitszeichen
| | Anhaltender feuchter Husten | Zystische Fibrose, rezidivierende Aspiration, IgG-Subklassenmangel, Immundefekt | | Ausgeprägtes Erbrechen oder „Spucken“ | Reflux, mit oder ohne Aspiration | |
Dysphagie | Probleme beim Schlucken, mit oder ohne Aspiration | | Unnormales Sprechen oder Schreien | Erkrankung des Kehlkopfes | | Lokalisierte Befunde bei der körperlichen
Untersuchung | Bronchiektasen, Tuberkulose, postvirale Syndrome, Entwicklungsstörung | | Inspiratorischer Stridor bei erschwerter Ausatmung | Erkrankung von Kehlkopf oder Trachea | | Mangelndes Gedeihen | Zystische
Fibrose, IgG-Subklassenmangel, Immundefekt, Gastroösophagealer Reflux | | Untersuchungen | | Lokalisierte oder bleibende radiologische Veränderungen | Entwicklungsstörung, postinfektiöse Veränderung, rezidivierende Aspirationen, Fremdkörper, Bronchiektasen, Tuberkulose | |
3.6.2 Risikofaktoren und Prognose des kindlichen Asthma bronchiale
Eine Kenntnis der Pathophysiologie und des Verlaufes der Asthma-Erkrankung kann therapeutische Entscheidungen, insbesondere prophylaktische Maßnahmen, beeinflussen.
Folgende Risikofaktoren sollten abgefragt oder abgeklärt werden: Leiden andere Familienmitglieder unter Asthma, Heuschnupfen, Neurodermitis oder Allergien (Atopie)?
Eine Familienanamnese von Asthma, Rhinitis und Atopie, insbesondere bei der Mutter, ist
der wichtigste und am besten erforschte Risikofaktor für kindliche atopische Erkrankungen. Asthma steht mit elterlicher und geschwisterlicher Atopie im Zusammenhang. Asthma und/oder Rhinitis bei der Mutter ist ein signifikanter Risikofaktor für ein später in der Kindheit einsetzendes Asthma. Im Zuge des Erwachsenwerdens nimmt der Einfluss dieser Risikofaktoren dann ab [357, 529, 59, 354, 339, 612, 589, 503, 112, 487, 567, 636, 360, 59].
Leidet oder litt das Kind unter Milchschorf, Allergien, Ekzemen, Neurodermitis oder Heuschnupfen?
Eine allergische Erkrankung zum Zeitpunkt der Asthmadiagnose (einschließlich Hauttest, Eosinophilie und Blutwerten wie z.B. RAST-Test) korrelieren mit der Schwere der Erkrankung und ihrem Fortbestehen während der Kindheit. Eine Aussage zur Langzeitprognose der Asthmasymptome und ihrer Schwere im Erwachsenenalter kann anhand dessen jedoch nicht gemacht werden [25, 31, 59, 59, 78, 272, 298, 357, 449, 469, 503, 564, 636, 637].
Geschlecht
In der frühen Kindheit tritt Asthma bei Jungen häufiger auf als bei Mädchen. Mädchen haben ein größeres Risiko, auch als Erwachsenen weiter unter Asthmasymptomen zu leiden. Bronchiolitis im Säuglingsalter
Das Auftreten von Giemen im Rahmen von Virusinfekten im Säuglingsalter setzt sich häufig in
der frühen Kindheit fort. Mit zunehmendem Alter nimmt diese Assoziation jedoch ab. Im Alter von 35 bis 40 Jahren findet sich bei Personen mit einer Anamnese von kindlichem Giemen im Vergleich zum Normalkollektiv kein Unterschied bzgl. der Lungenfunktion und der bronchialen Hyperreagibilität [39, 207, 299, 355, 360, 469, 552, 553, 555, 557, 567]. Rauchen die Eltern?
Mütterliches Rauchen erhöht signifikant die Inzidenz von Giemen bei Kleinkindern. Zwischen dem elterlichen Rauchen und Atemwegssymptomen im späteren Leben besteht keine Assoziation. Durch eine Reduktion des Rauchens in der erwachsenen Bevölkerung und
insbesondere bei Frauen im gebärfähigen Alter, ließe sich das Auftreten kindlichen Giemens signifikant reduzieren [39, 271, 324, 339, 354, 357, 360, 503, 529, 577, 589].
Geburtsgewicht und Frühgeburtlichkeit
Frühgeborene Kinder neigen vermehrt zum Giemen. Im Erwachsenenalter findet sich jedoch keine Assoziation von Geburtsgewicht und Auftreten einer Asthmaerkrankung [226, 324, 529, 533, 567, 577]. Alter bei Erstpräsentation
Je früher ein Kind unter bronchialer Obstruktion (Giemen) leidet, desto besser ist die
Prognose. Bei Kindern unter zwei Jahren verschwindet die Obstruktion meist von selbst. Eine zusätzlich bestehende Atopie ist jedoch unabhängig vom Präsentationsalter ein Risikofaktor für das Fortbestehen von Atemwegssymptomen [7, 59, 114, 149, 269, 272, 340, 355, 356, 426, 469, 564, 594, 650]. Erkrankungsschwere und Anfallshäufigkeit
Die Schwere der Asthmaerkrankung eines Kindes ist ein Prädiktor für die Erkrankungspersistenz im Erwachsenenalter [59, 112, 269, 298, 353, 355, 426, 488, 489, 564, 577, 637].
3.6.3 Lungenfunktion (bei Kindern)
Es besteht ein Zusammenhang zwischen der Lungenfunktionseinschränkung in der Kindheit und im Erwachsenenalter. Eine durchgehende Einschränkung der Lungenfunktionsparameter und eine
erhöhte bronchiale Hyperreagibilität sind mit einer Erkrankungspersistenz ins Erwachsenenalter assoziiert [39, 78, 201, 207, 269, 355, 488, 489, 577, 602]. = >Wenn möglich, sollte auch bei Kindern mit Asthma eine objektive Lungenfunktionsuntersuchung durchgeführt werden.
3.6.4 Indikationen für eine Überweisung eines Kindes zum Facharzt [551]
- Diagnose Asthma unsicher oder zweifelhaft
- Symptome von Geburt an vorhanden oder Atmungsprobleme während der Geburt
- Ausgeprägtes Erbrechen oder “Spucken”
- Schwere Infektion der oberen Atemwege
- Anhaltender feucht-schleimiger Husten
- Lungen-, Atemwegs- oder Atempumpenerkrankungen in der Familie
- Gedeihstörung
- Ungewöhnliche klinische Befunde z.B. lokalisierte Untersuchungsbefunde bei der
Auskultation oder klinischen Untersuchung, unnormales Sprechen oder Schreien, Dysphagie, inspiratorischer Stridor
- Unzureichendes Ansprechen auf konventionelle Therapie insbesondere hohe inhalative Steroiddosen (>400 µg/Tag) oder häufiger Einsatz von Steroidtabletten
- Angst oder Unsicherheit von Seiten der Eltern/Betreuer
3.7 Einschätzung des Schweregrades und des Risikos des Asthmas
3.7.1 Schweregradeinschätzung des Asthma bronchiale [627]
Schweregrad 1, intermittierendes Asthma:
< 2 Symptome über Tag / Woche, <2x nachts/Monat; PEF >80% Schweregrad 2, persistierendes leichtes Asthma:
<1x täglich, > 2x nachts / Monat; PEF >=80% Schweregrad 3, persistierendes mittelschweres Asthma:
täglich Symptome, nachts >1x/Woche Symptome; PEF 60-80% Schweregrad 4 persistierendes schweres Asthma:
keine Symptomfreiheit am Tag, häufige Symptomatik nachts; PEF < 60%
3.7.2 Risikopatienten
Folgende Patientengruppen tragen ein erhöhtes Risiko, einen lebensbedrohlichen oder tödlichen Asthmaanfall zu erleiden [84, 86, 377, 619]: Kombination eines schweren Asthma bronchiale charakterisiert durch: - Lebensbedrohlicher Asthmaanfall in der Vergangenheit
- Stationäre Krankenhausaufenthalte wegen Asthma, insbesondere im letzten Jahr
- Nutzung von drei oder mehr Asthmamedikamenten
- Häufiger Gebrauch von Beta2-Sympathomimetika
- Häufiges Aufsuchen der Notaufnahme, insbesondere im letzten Jahr
- Instabiles (‚brittle‘) Asthma
mit auffälligen Verhaltensmustern oder psychosozialen Einflüssen charakterisiert durch: - Non-Compliance bezüglich Therapie oder Verlaufskontrollen
- Nichteinhalten von Arztterminen
- Selbstentlassung aus dem Krankenhaus
- Psychose, Depression, sonstige psychiatrische Erkrankung oder Autoaggression
- Aktueller oder kürzlich zurückliegender Tranquillantienmissbrauch
- Fehlende Krankheitseinsicht
- Alkohol- oder Drogenmissbrauch
- Adipositas
- Lernschwierigkeiten
- Berufliche Probleme oder Arbeitslosigkeit
- Wirtschaftliche Probleme
- Soziale Isolation
- Kindesmisshandlung
- Häusliche, eheliche oder juristische Probleme
Weiter: Asthma-Therapie
| 
